
▲ 기초과학연구원(IBS) RNA 연구단이 mRNA 백신의 세포 내 전달과 분해를 제어하는 단백질 군을 찾아내고 그 작동원리를 세계 최초로 규명했다. 사진은 김빛내리 기초과학연구단(IBS) 전령 리보핵산(RNA) 연구단장(왼쪽)과 김명환 IBS RNA 연구단 연구원(오른쪽).
과학기술정보통신부는 4일 기초과학연구원(IBS) RNA 연구단 김빛내리 단장(서울대 생명과학부 석좌교수) 연구진이 mRNA 백신의 세포 내 전달과 분해를 제어하는 단백질 군을 찾아내고 그 작동원리를 최초로 규명했다고 밝혔다.
이번 연구 결과는 세계 최고 권위 학술지 사이언스(Science, IF 44.7)에 4일 온라인으로 실렸다.
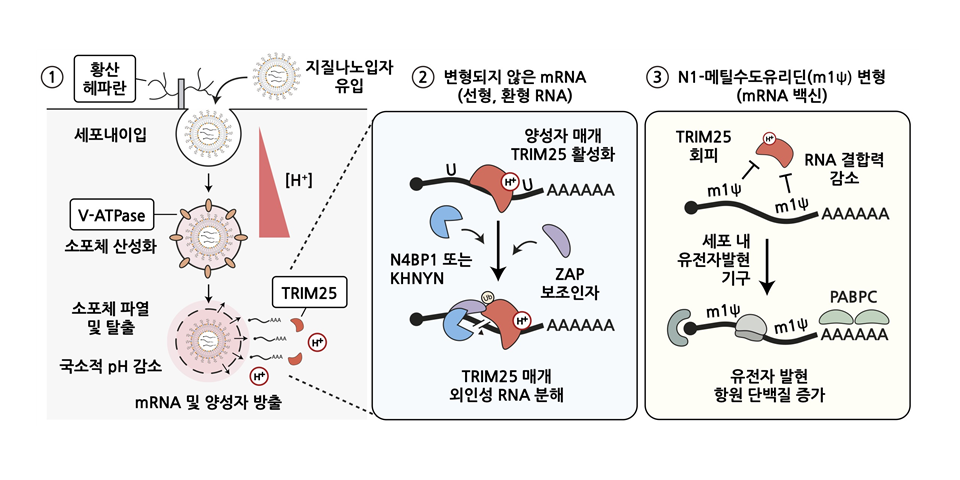
연구진은 △mRNA이 세포 내로 전달·유입되는 데 필요한 핵심 단백질 인자들과 조절 경로 △리보핵산(RNA) 치료제에 대한 주요 억제 인자와 외부 리보핵산(RNA)의 침입을 경보하는 양성자 이온의 역할 △mRNA을 결합·제거하는 TRIM25 단백질이 N1-메틸수도유리딘 변형 염기에는 그 결합력이 현저히 감소하여 전령 리보핵산(mRNA)을 절단·분해하지 못한다는 사실을 발견했다.
세포막 표면에 있는 ‘황산 헤파란’ 분자는 mRNA를 감싼 지질나노입자와 결합해 세포 내 유입을 촉진한다.
이를 통해 지질나노입자는 세포내 소포체로 들어간다. 황산 헤파란은 세포 표면에 존재하는 황산화된 당단백질로, 병원체 감염과 나노입자의 세포 부착 등 외부 물질이 세포 내로 유입되는 데 중요한 매개체로 작용한다.
양성자 이온 펌프 ‘V-ATPase’는 소포체 내부를 산성화시키고 지질나노입자가 양전하를 띄도록 해 소포체 막을 일시적으로 파열시킨다.
이 막이 깨지면서 mRNA이 세포질로 방출돼 단백질로 발현된다. V-ATPase는 V형 ATP 가수분해효소, 양성자 이온을 소포 내부로 펌핑·산성화시키며. 수소이온 농도지수(pH)를 조절하여 세포 신호 전달, 물질 수송 등 다양한 세포 과정을 지원한다.
▲ mRNA 백신의 주요 세포 조절 경로와 N1-메틸수도유리딘 변형 염기 효과의 분자 기전. <과학기술정보통신부>
세포질 내 ‘TRIM25’ 단백질은 mRNA를 침입자로 인식하고 제거한다. 이 단백질은 소포체 막이 파열되면서 방출되는 양성자 이온에 의해 활성화되며, 외인성 RNA에 특이적으로 표적・결합하여 다른 절단 효소 및 보조 단백질과 함께 RNA를 빠르게 절단하고 분해한다. TRIM25는 바이러스 감염 등에 대한 선천성 반응을 조절하는 RNA 결합 단백질이자 연결효소를 말한다.
아울러 mRNA를 결합·제거하는 TRIM25 단백질이 N1-메틸수도유리딘 변형 염기에는 그 결합력이 현저히 감소해 mRNA를 절단·분해하지 못한다는 사실도 발견했다.
과학기술정보통신부 관계자는 “이번 연구는 mRNA 백신의 세포 내 작동 원리를 최초로 밝혀, mRNA 치료제의 효능과 안정성을 높이는 이론적 토대를 마련했다는 점에서 의미가 크다”고 말했다.
김빛내리 기초과학연구단(IBS) 단장은 “양성자 이온이 면역 신호 전달 물질로 작용한다는 사실을 처음으로 발견했다”며 “세포가 외부 침입자에 대응하는 방어 기전에 대한 이해를 넓혔을 뿐 아니라, RNA뿐 아니라 면역과 세포 신호 분야에도 새로운 연구 방향을 제시할 것으로 보인다”고 말했다. 김민정 기자











